Карбоновые кислоты
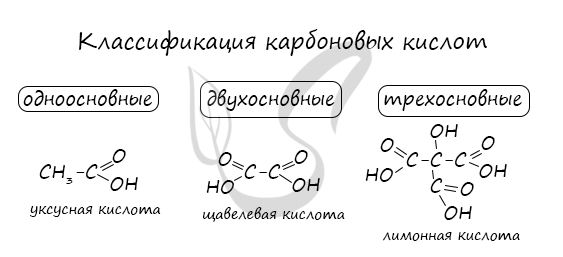
Классификация карбоновых кислот
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
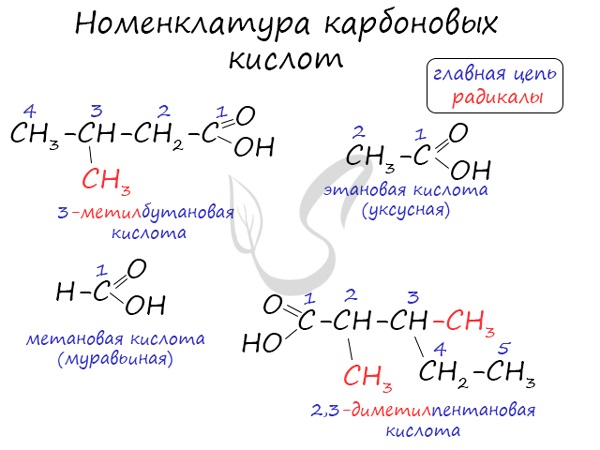
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
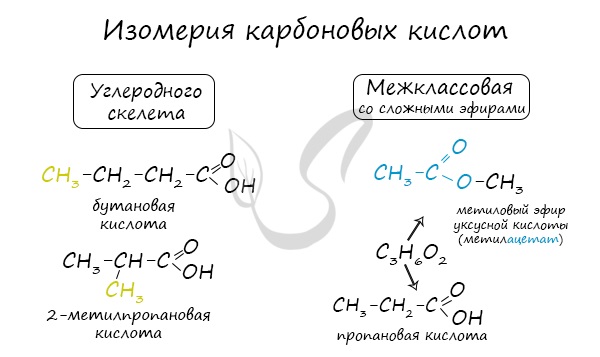
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
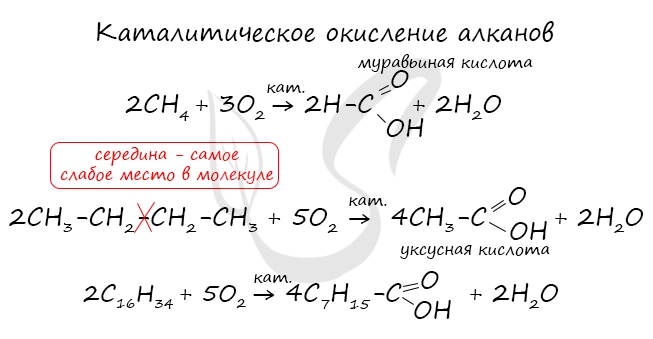
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
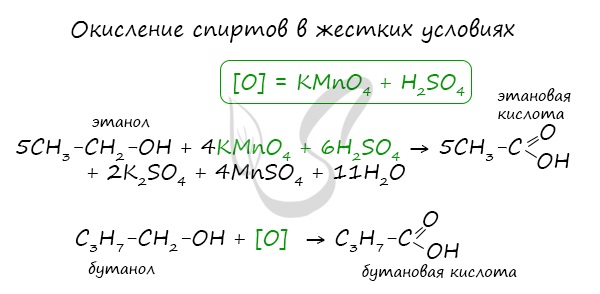
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
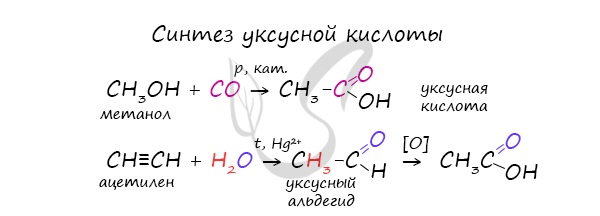
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
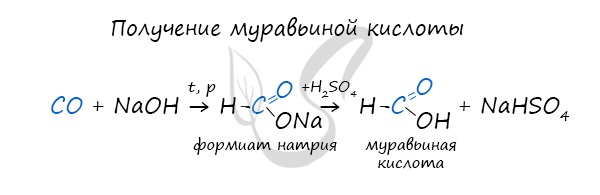
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
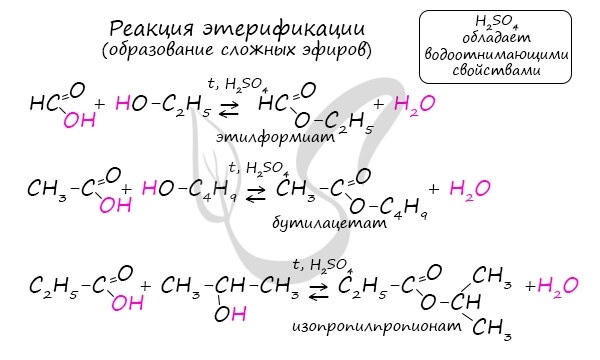
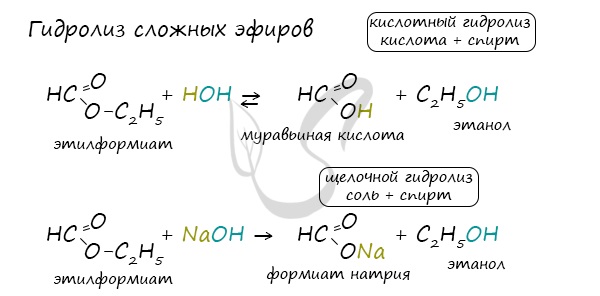
Сложные эфиры
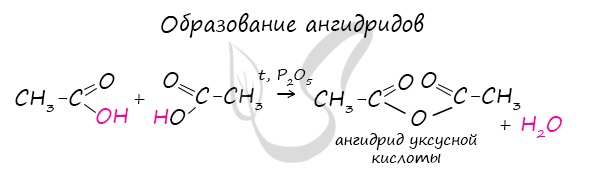
Ангидриды
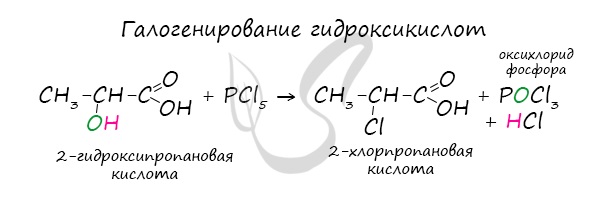
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
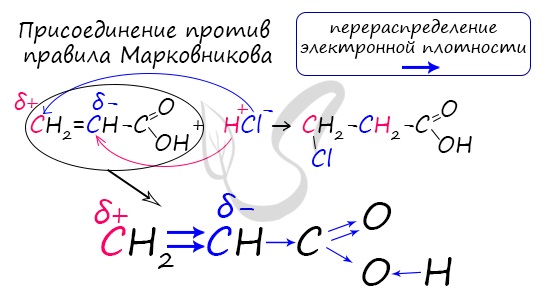
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Формулы высших карбоновых кислот и их названия
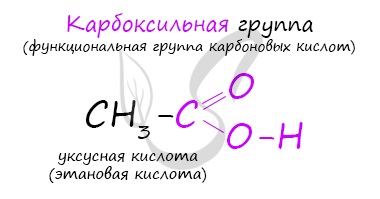
1. Карбоновые кислоты – это кислородсодержащие органически вещества, молекулы которых содержат одну или несколько карбоксильных групп
(-С OOH ), соединённых с углеродным радикалом или водородным атомом.
А) По числу карбоксильных групп в молекуле
Метановая, муравьиная кислота
Этановая, уксусная кислота

Б) По природе углеводородного радикала
1) Предельные (насыщенные)
Метановая, муравьиная кислота
Этановая, уксусная кислота
С6Н5СООН – бензойная кислота
НООС–С6Н4–СООН Пара-терефталевая кислота
3. Изомерия и номенклатура
А) Изомерия углеродного скелета (начиная с C 4 )
CH 3— CH 2— COOH пропионовая кислота
Б) Цис- транс – изомерия для непредельных кислот

4. Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота.
Чтобы указать положение заместителя (или радикала), нумерацию углеродной цепи начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной углеродной цепью (CH3)2CH-CH2-COOH называется 3-метилбутановая кислота. Для органических кислот широко используются также тривиальные названия, которые обычно отражают природный источник, где были впервые обнаружены эти соединения.
Некоторые одноосновные кислоты
Название кислоты R-COOH
ПРЕДЕЛЬНЫЕ ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
Строение карбоксильной группы
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Физические свойства предельных одноосновных кислот
Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда — вязкие, «маслообразные» жидкости; начиная с С10 — твердые вещества.
Х и м и я
Органическая химия
Карбоновые кислоты.
Строение карбоновых кислот
Карбоксильная группа является функциональной (характеристической) группой этого класса соединений. Примерами карбоновых кислот могут служить:
Свойства карбоновых кислот.
Кислотный характер этих соединений является результатом того, что атом водорода гидроксильной группы способен диссоциировать с образованием иона водорода, например:
Взаимодействуя с основаниями карбоновые кислоты образуют соли:
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимоми гидролизу. Наиболее сильные из карбоновых кислот – муравьиная и уксусная.
Карбоновые кислоты со спиртами образуют сложные эфиры. Сложные эфиры – чрезвычайно важное соединение, очень часто встречающееся в продуктах животного и растительного мира.
Классификация карбоновых кислот.
Карбоновые кислоты можно классифицировать по различным признакам:
Одноосновные и двухосновные карбоновые кислоты.
Карбоновые кислоты делятся одноосновные и двухосновные в зависимости от кличества в их составе гидроксильных групп ОН.
Все карбоновые кислоты, рассмотренные выше – это примеры одноосновных кислот. В их сотавах содержится по одной гидроксильной группе.
Соответственно, в молекулах двухосновных кислот содержится по две гидроксильных группы. К двухосновным карбоновым кислотам относятся, например, щавелевая или терефталиевая кислоты.
Низшие, средние и высшие карбоновые кислоты.
По числу атомов углерода в молекуле карбоновые кислоты делят на:
Высшие карбоновые кислоты называют высшими жирными кислотами, по причине того, что они входят в состав природных жиров.
Но иногда жирными называют все ациклические карбоновые кислоты. Таким образом, термины «жирные кислоты» и «карбоновые кислоты» часто используются как синонимы.
Предельные и непредельные карбоновые кислоты.
Предельные карбоновые кислоты в своём составе, содержат радикал предельных углеводородов, т.е. радикал только с простыми, одинарными связями.
И наоборот, непредельные карбоновые кислоты в своём составе содержат радикал непредельных углеводородов, т.е. радикал, в котором присутствуют кратные (двойные и тройные) связи.
Высшие карбоновые (жирные) кислоты
Напомним, что высшим карбоновым кислотам относят такие карбоновые кислоты, молекулы которых содержат сравнительно большое число атомов углерода (С9-С26).
По причине того, что высшие карбоновые кислоты входят в состав животных и растительных жиров их называют высшими жирными кислотами.
Примеры предельных высших жирных кислот:
Примеры непредельных высших жирных кислот:
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:
В углеводородной цепи атомы углерода расположены не по прямой линии, а виде «змейки». Угол между двумя соседними отрезками такой «змейки» 109 градусов 28 минут. В случае двойной связи угол другой. В структурной формуле каждая вершина такой «змейки» означает атом углерода, соединённый с двумя атомами водорода. Последний атом углерода соединён с тремя атомами водорода. При этом сами символы углерода (С) и водорода(Н) не изображаются.
Предельные и непредельные жирные кислоты имеют в значительной степени различные свойства.
Высшие предельные кислоты – воскообразные вещества, непредельные – жидкости (напоминающие растительное масло).
Натриевые и калиевые соли высших жирных кислот называют мылами.
Натриевые мыла – твёрдые, калиевые – жидкие.
Примеры карбоновых кислот
Уксусная кислота
Уксусная кислота – жилкость с острым раздражающим запахом.
Температура кипения 118,5 градусов С, при +16,6 градусах С застывает в кристаллическую массу, похожую на лёд.
Смешивается с водой в любых соотношениях.
Широко применяется как прправа к пище и консервирующее средство. В продаже встречается в виде уксусной эссенции (80%) и уксуса (9,3%).
Натуральный или винный уксус – продукт, содержащий уксусную кислоту и получающийся при скисании виноградного вина.
Уксусная кислота используется также при синтезе многих органических веществ и в качестве растворителя.
Уксусную кислоту получают преимущественно синтезом из ацетилена – присоединением к нему воды и окислением образующегося уксусного альдегида.
Бензойная кислота
Бензойная кислота простейшая одноосновная кислота ароматического ряда. Формула С6Н5-СООН.
На вид – бесцветные кристаллы.
Бензойная кислота – антисептик. Применяется для консервирования пищевых продуктови во многих органических синтезах.
Щавелевая кислота
Щавелевая кислота – простейшая двухосновная карбоновая кислота.
Щавелевая кислота – кристаллическое вещество, растворяется в воде, ядовита.
В виде кислой калиевой соли содержится во многих растениях.
Применяется для крашения тканей.
Терефталевая кислота
Двухосновная карбоновая кислота ароматического ядра.
Её структурная формула:
Из терефталевой кислоты и этиленгликоля получают синтетическое волокно лавсан.
Молочная кислота
Молочная кислота может служить примером соединения со смешанными функциями – проявляет свойства кислоты и спирта (спиртокислота)
Она образуется при молочнокислом брожении сахаристых веществ, вызываемых особыми бактериями. Содержится в кислом молоке, рассоле квашеной капусты, силосе.
Салициловая кислота
Салициловая кислота – аналог молочной кислоты в ароматическом ряду. Имеет строение:
Относится к соединениям со смешанными функциями – проявляет свойства кислоты и фенола (фенолокислота).
Салициловая кислота – антисептик. Её используют (особенно её соли и эфиры) как лекарственное вещество.
Также салициловую кислоту используют при синтезе других продуктов.